Qorvo Biotechnologies 公司的 COVID-19 抗原快速檢測(cè)獲得 FDA 緊急使用授權(quán) (EUA),可用于現(xiàn)場(chǎng)護(hù)理環(huán)境
2022-08-10
來(lái)源:Qorvo
中國(guó)北京 - 2022 年 8 月 10 日-移動(dòng)應(yīng)用、基礎(chǔ)設(shè)施與航空航天、國(guó)防應(yīng)用中 RF 解決方案的領(lǐng)先供應(yīng)商 Qorvo, Inc.(納斯達(dá)克代碼:QRVO)今天宣布,美國(guó)食品和藥物管理局 (FDA) 已為 Qorvo 的 Omnia SARS-CoV-2 抗原檢測(cè)頒發(fā)了緊急使用授權(quán) (EUA),使其可用于現(xiàn)場(chǎng)護(hù)理 (POC) 環(huán)境。
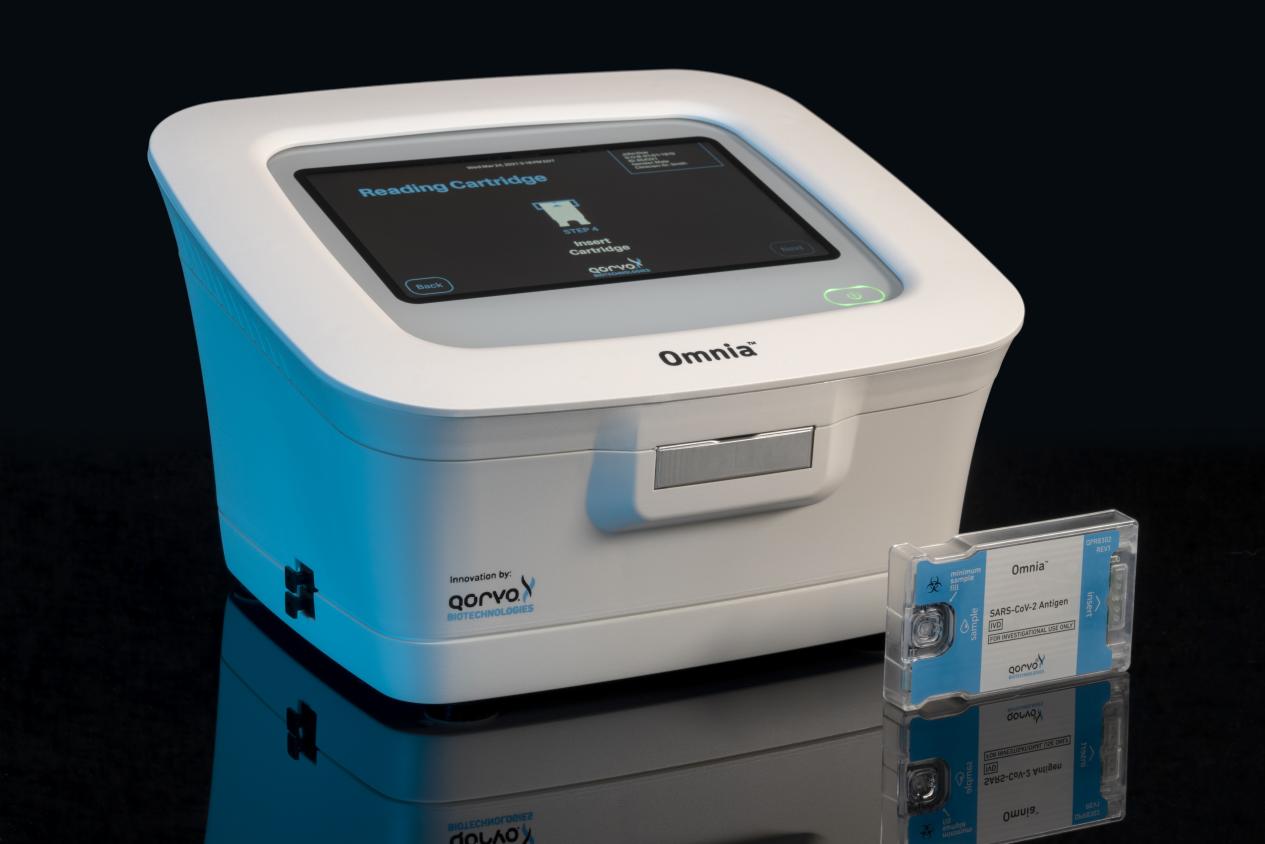
該檢測(cè)被授權(quán)用于在癥狀發(fā)作后的六天內(nèi)進(jìn)行定性檢測(cè),確定疑似 COVID-19 患者鼻拭子標(biāo)本中是否存在 SARS-CoV-2 (COVID-19) 的核衣殼病毒抗原。此外,該檢測(cè)還被授權(quán)用于暫無(wú)疑似 COVID-19 癥狀或其他流行病學(xué)表現(xiàn)的風(fēng)險(xiǎn)人群,規(guī)則為在三天內(nèi)檢測(cè)兩次,檢測(cè)間隔時(shí)間不少于 24 小時(shí)且不超過(guò) 48 小時(shí)。此前,F(xiàn)DA 已對(duì)該檢測(cè)頒發(fā)緊急使用授權(quán),批準(zhǔn)將其用于實(shí)驗(yàn)室等中等和高度復(fù)雜環(huán)境。此次緊急使用授權(quán)將 Qorvo 的市場(chǎng)拓展至實(shí)驗(yàn)室之外,包括醫(yī)生辦公室、急診中心、零售藥店、員工健康檢測(cè),以及任何其他可進(jìn)行臨床實(shí)驗(yàn)室改進(jìn)修正案 (CLIA) 豁免檢測(cè)的場(chǎng)所。
Qorvo 新任副總裁兼 Qorvo Biotechnologies 總裁 Erik Allen 表示:“隨著 COVID-19 檢測(cè)趨于普遍化,并且?jiàn)W密克戎變異株的病毒載量降低,現(xiàn)場(chǎng)護(hù)理環(huán)境需要高質(zhì)量的快速檢測(cè)基礎(chǔ)設(shè)施。Qorvo Omnia 平臺(tái)提供了獨(dú)到的組合形式,結(jié)合性能、自動(dòng)化工作流程和可拓展性,從而高效滿足現(xiàn)場(chǎng)檢測(cè)需求。”
Qorvo Omnia 平臺(tái)采用創(chuàng)新診斷技術(shù),通過(guò)高頻體聲波 (BAW) 傳感器,在一個(gè)易于使用的獨(dú)立平臺(tái)上快速得出高度敏感和特異的 COVID-19 檢測(cè)結(jié)果。BAW 傳感器技術(shù)可達(dá)到近似于分子檢測(cè)能力的低檢測(cè)限 (LOD) 水平。隨著病毒載量下降,尤其是隨著奧密克戎變異株及亞型株的出現(xiàn),患者樣本中的病毒載量較低,對(duì)現(xiàn)有的非處方 (OTC) 側(cè)向流動(dòng)檢測(cè)造成了挑戰(zhàn)。Qorvo Omnia 平臺(tái)則具備技術(shù)優(yōu)勢(shì),能夠在奧密克戎高峰期內(nèi)持續(xù)準(zhǔn)確檢測(cè) COVID-19 的相關(guān)抗原。
Qorvo Omnia 平臺(tái)在對(duì)比 PCR 方法的檢測(cè)限 (LOD) 方面表現(xiàn)出色。Omnia 平臺(tái)在臨床研究期間顯示出 85% 的靈敏度 (PPA),支持設(shè)備緊急使用授權(quán),可用于現(xiàn)場(chǎng)護(hù)理;此項(xiàng)目由美國(guó)國(guó)立衛(wèi)生研究院 (NIH) 撥款出資,并于 2021 下半年正式開(kāi)展。2022 年初奧密克戎變異株廣泛傳播期間,NIH 資助開(kāi)展獨(dú)立研究。在該研究中,當(dāng)樣本達(dá)到或超過(guò)對(duì)比 PCR 方法的檢測(cè)限時(shí),Qorvo 依然表現(xiàn)出色,靈敏度達(dá)到 86%。所有相關(guān)研究中,特異性均達(dá)到 100%。
醫(yī)療咨詢公司 Traeokos 總裁兼首席執(zhí)行官 Peter Matos 表示:“如今,檢測(cè)需求隨著奧密克戎變異株性的產(chǎn)生而發(fā)生變化,Qorvo 的抗原檢測(cè)為客戶確保了多種檢測(cè)場(chǎng)景中所需的性能水平。”
欲知更多信息,請(qǐng)?jiān)L問(wèn) www.qorvobiotech.com 。
該項(xiàng)目由美國(guó)衛(wèi)生與公眾服務(wù)部下屬、美國(guó)國(guó)立衛(wèi)生研究院的美國(guó)國(guó)家生物醫(yī)學(xué)影像與生物工程研究所的聯(lián)邦資金提供全部或部分資助,合同編號(hào)為 75N92021C00008。
2021 年 4 月,美國(guó)食品和藥物管理局 (FDA) 為 Qorvo Omnia 的 SARS-CoV-2 抗原檢測(cè)頒布了緊急使用授權(quán) (EUA),用于中等和高度復(fù)雜環(huán)境,自 2022 年 7 月起亦可用于現(xiàn)場(chǎng)護(hù)理環(huán)境。
Qorvo Omnia SARS-CoV-2 抗原檢測(cè)尚未獲得 FDA 許可或批準(zhǔn)。經(jīng) FDA 根據(jù)“緊急使用授權(quán)”條例授權(quán),只能通過(guò)《1988 年臨床實(shí)驗(yàn)室改進(jìn)修正案》(CLIA),42 U.S.C. §263a 認(rèn)證的實(shí)驗(yàn)室執(zhí)行豁免、中等或高度復(fù)雜的測(cè)試。該項(xiàng)檢測(cè)僅被授權(quán)用于檢測(cè)來(lái)自 SARS-CoV-2 的蛋白質(zhì),不適用于任何其他病毒或病原體。這些測(cè)試僅授權(quán)用于聲明的期間,即根據(jù)“緊急使用授權(quán)”法案第 564(b)(1) 節(jié),21 U.S.C. § 360bbb-3(b)(1),有理由授權(quán)緊急使用體外診斷測(cè)試來(lái)檢測(cè)和/或診斷 COVID-19 的情況,除非該授權(quán)提前終止或撤銷。
更多信息可以來(lái)這里獲取==>>電子技術(shù)應(yīng)用-AET<<


