文獻(xiàn)標(biāo)識碼: A
DOI:10.16157/j.issn.0258-7998.2017.07.021
中文引用格式: 李生輝,盧小冬,黃成軍. 高通量可尋址細(xì)胞捕獲芯片控制系統(tǒng)的設(shè)計(jì)[J].電子技術(shù)應(yīng)用,2017,43(7):81-83,87.
英文引用格式: Li Shenghui,Lu Xiaodong,Huang Chengjun. Electrical control system design for a high throughput and addressable cell capture biochip[J].Application of Electronic Technique,2017,43(7):81-83,87.
0 引言
惡性腫瘤已成為我國死亡率最高的重大疾病之一,90%以上的腫瘤病人死于腫瘤的轉(zhuǎn)移和復(fù)發(fā)[1]。最新的研究表明,血液中的循環(huán)腫瘤細(xì)胞(Circulating Tumor Cells,CTCs)由于其直接來于源腫瘤組織,可以直接反應(yīng)腫瘤的大小、類型等,用于多種腫瘤的療效評價(jià)、復(fù)發(fā)及轉(zhuǎn)移的監(jiān)測。建立高通量、高靈敏度的CTCs檢測方法,是近年來的研究熱點(diǎn),具有重要的科學(xué)意義和臨床應(yīng)用價(jià)值[2]。
當(dāng)前CTCs的檢測方法主要分為兩大類,一類是依靠識別表達(dá)于腫瘤細(xì)胞膜表面的特異性標(biāo)志物(如EpCAM、HER-2等)來實(shí)現(xiàn)CTCs的捕獲與鑒定;另一類則是直接利用CTCs自身的物理特性(如在大小、密度、電學(xué)特性等方面)與普通細(xì)胞的差異來實(shí)現(xiàn)CTCs的捕獲與檢測。近年來,隨著微流控芯片技術(shù)的發(fā)展,基于CTCs物理特性的“免標(biāo)記”檢測方式越來越受到重視。基于細(xì)胞介電電泳(Dielectrophoresis,DEP)原理的CTCs捕獲技術(shù),因?yàn)檩^高的特異性和非侵入性,受到研究者的青睞。GASCOYNE P R研究發(fā)現(xiàn),不同種類的細(xì)胞,存在著一個具有較高特異性的介電電泳特征譜,可用于不同腫瘤細(xì)胞的分離[3]。基于這種介電特性,不同的研究小組設(shè)計(jì)了形式各異的介電電泳細(xì)胞捕獲生物芯片,用于CTCs的分離與檢測[4-5]。HUANG C設(shè)計(jì)了一種四電極系統(tǒng)芯片,可以實(shí)現(xiàn)對單個腫瘤細(xì)胞的特異性捕獲、定位及細(xì)胞電裂解等多種功能[6]。但是,該種介電電泳細(xì)胞捕獲芯片的每個微電極都由一路獨(dú)立的電信號驅(qū)動,在有限的芯片面積上,只能實(shí)現(xiàn)單個或少數(shù)腫瘤細(xì)胞的檢測,通量較低。
本文提出了適用于一種高通量的介電電泳細(xì)胞芯片的控制電路系統(tǒng)。通過該系統(tǒng)的控制程序和尋址電路,可以實(shí)現(xiàn)對具有32×32微電極單元的陣列型細(xì)胞捕獲生物芯片進(jìn)行微電極單元尋址、介電電泳電壓信號加載、程序UI智能控制等功能,從而為高通量、可尋址的細(xì)胞捕獲生物芯片的研究提供了一種解決方案。
1 細(xì)胞捕獲芯片的工作機(jī)理
細(xì)胞處在非均勻電場中,由于極化效應(yīng)產(chǎn)生介電電泳現(xiàn)象[7]。細(xì)胞所受的介電電泳力跟電極上所加信號的幅度、頻率、電極間的距離、細(xì)胞自身的物理特性(如細(xì)胞膜電容、電導(dǎo)等)有關(guān)。為了利用細(xì)胞的介電電泳效應(yīng)特異性的捕獲腫瘤細(xì)胞,在細(xì)胞捕獲芯片上加載的介電電泳信號是至關(guān)重要的。
本文所設(shè)計(jì)電路控制系統(tǒng)驅(qū)動的細(xì)胞捕獲生物芯片如圖1所示。芯片為32×32的陣列結(jié)構(gòu),共1 024個單元,每個單元由一對微電極構(gòu)成。所設(shè)計(jì)的電路控制系統(tǒng)需要實(shí)現(xiàn)對該1 024個單元的尋址,并將特定幅值、相位和頻率的交流信號加載到使能的微電極對上,以用于介電電泳細(xì)胞捕獲[7]。

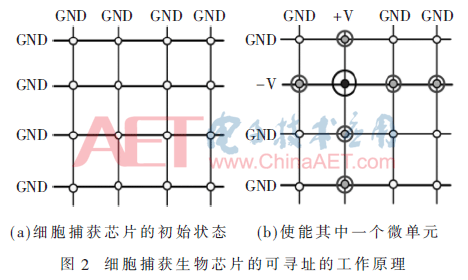
針對圖1介電電泳細(xì)胞捕獲生物芯片的控制電路需求,本文提出的驅(qū)動電路設(shè)計(jì)方案基于圖2的工作原理,以4行×4列的微電極陣列為例,微電極陣列的所有行和列電極都接地(GND),均處于非使能狀態(tài),如圖2(a)所示;當(dāng)需要使能第2行、第2列微電極單元,如圖2(b)所示,控制系統(tǒng)將第2列的電極加載正弦波,第2行的電極加載反相正弦波;而處在第2行或第2列的其他微電極單元,由于僅一個微電極加載有正弦波信號,所以產(chǎn)生的介電電泳力僅為第2行、第2列微電極單元的1/4[7],通過調(diào)整正弦波信號的幅度、頻率,僅使第2行、第2列的微電極產(chǎn)生的介電電泳力高于細(xì)胞捕獲的閾值,而第2行其他列(或第2列其他行)的介電電泳力均小于該閾值,從而實(shí)現(xiàn)對細(xì)胞捕獲芯片上1 024個微電極單元的尋址功能。
2 細(xì)胞捕獲生物芯片電學(xué)控制系統(tǒng)的設(shè)計(jì)
2.1 系統(tǒng)總體設(shè)計(jì)
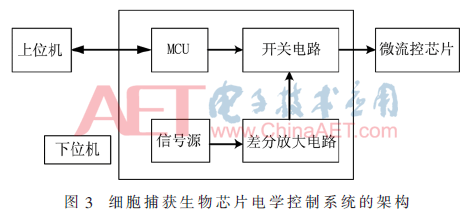
該系統(tǒng)包括上位機(jī)的控制程序模塊和下位機(jī)的控制電路模塊。下位機(jī)的控制模塊又包括微控制器(MCU)控制單元、信號產(chǎn)生單元、開關(guān)控制單元。上位機(jī)的控制程序通過USB控制下位機(jī),同時給下位機(jī)供電;下位機(jī)由一個微控制器來控制開關(guān)電路;差分放大電路將信號發(fā)生器產(chǎn)生的單路正弦波信號轉(zhuǎn)換成兩路相位差為π的正弦信號,再通過由MCU控制的開關(guān)電路,將兩路差分信號輸出給指定的微流控芯片的行電極和列電極。其系統(tǒng)框圖如圖3所示。
2.2 上位機(jī)的控制程序模塊設(shè)計(jì)
由于該細(xì)胞捕獲生物芯片的電學(xué)控制系統(tǒng)需要對64路輸出通道進(jìn)行控制,為了方便操作者智能、快速地操控,本文設(shè)計(jì)了基于Qt開發(fā)上位機(jī)的控制程序模塊,主要通過USB實(shí)現(xiàn)與下位機(jī)的控制電路連接的功能。實(shí)驗(yàn)中,顯微鏡的CCD相機(jī)拍攝到微電極陣列芯片的照片后,可以在上位機(jī)控制程序中進(jìn)行添加、編輯等操作,操作者可以通過上位機(jī)控制程序用戶界面(UI)來觀察芯片上的微電極陣列。根據(jù)不同的細(xì)胞實(shí)驗(yàn)需求,當(dāng)需要使能特定的行和列時,在上位機(jī)控制程序UI中點(diǎn)擊相應(yīng)的行和列的按鈕,即可使能該微電極單元,再次點(diǎn)擊即可不使能該微電極單元。為了擴(kuò)展功能,上位機(jī)控制程序還可以實(shí)現(xiàn)一鍵使能或不使能所有行電極和列電極,從而達(dá)到上位機(jī)智能控制的目的。
2.3 下位機(jī)控制電路模塊設(shè)計(jì)
下位機(jī)控制電路模塊的主要部分是微控制器(MCU)單元,它負(fù)責(zé)與上位機(jī)之間的通信,同時控制下位機(jī)中其他的電路模塊。64路通道的微電極陣列芯片,其32行、32列的64個電極需要選擇性加載正弦波信號,同時行電極和列電極的所加的正弦波信號的相位差為π。要對信號的選擇性導(dǎo)通,下位機(jī)控制模塊中就需要模擬開關(guān)單元;正弦波信號的差分輸出就需要差分放大單元。下位機(jī)控制電路模塊設(shè)計(jì)如圖4所示,主要包括微控制器(MCU)單元、差分放大單元、模擬開關(guān)單元3個部分。
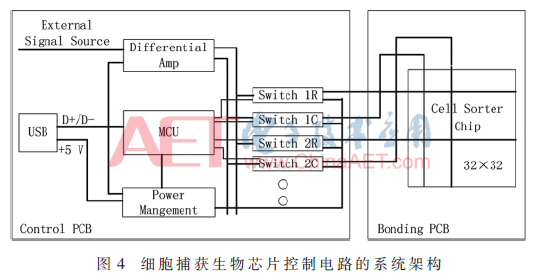
MCU選擇ST的STM32F105VCT6,有80個可用的IO資源,完全滿足64路輸出通道的需求。差分放大芯片選擇ADI高速差分放大器AD8132,它是一款低成本、差分或單端輸入的差分輸出放大器,通過電阻設(shè)置增益[8]。開關(guān)電路選用ADI的四路獨(dú)立單刀雙擲開關(guān)芯片ADG333A,具有低導(dǎo)通阻抗。
基于AD8132的差分放大電路的原理圖如圖5所示。
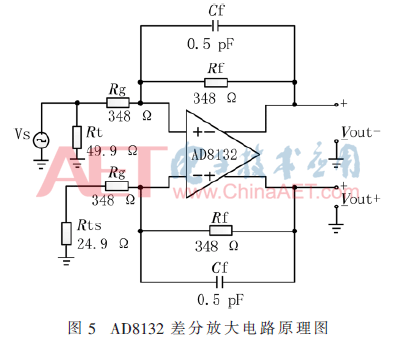
AD8132提供了兩個等比反饋網(wǎng)路,為了匹配寄生效應(yīng),這兩個網(wǎng)絡(luò)由兩個等值反饋電阻(Rf)和兩個等值增益電阻(Rg)構(gòu)成[7]。而且電路中,差模輸出增益G=Rf/Rg,所以可以通過調(diào)整Rf和Rg的電阻比例大小來調(diào)整電路的增益,本文設(shè)計(jì)中,要求增益為1,故使Rf和Rg阻值相等。
3 系統(tǒng)功能測試
根據(jù)圖4所示的系統(tǒng)架構(gòu)設(shè)計(jì)了電路原理圖,制備了印制電路板,并進(jìn)行了元器件的焊接,然后對其電學(xué)性能進(jìn)行了測試,搭建了測試平臺。當(dāng)需要尋址特定微電極單元時,通過操作上位機(jī),點(diǎn)擊相應(yīng)上位機(jī)控制程序UI的行按鈕和列按鈕,實(shí)現(xiàn)對該微電極單元的使能,將正相、反相正弦電壓信號加載到該微電機(jī)單元。差分放大單元的輸入信號由Aligent的33621A信號發(fā)生器(輸出信號最大頻率可達(dá)120 MHz)產(chǎn)生。采用Aligent的四通道示波器MSO-X 2024A(最高頻率可達(dá)200 MHz)實(shí)時觀測加載到指定微電極單元的信號。
電路測試結(jié)果如圖6所示,當(dāng)輸入信號為Vpp=2 V、頻率為1 kHz的正弦波時,經(jīng)本文的控制電路后,由于差分放大電路的增益G=1,此時兩路單端輸出信號為1 kHz、峰峰值Vpp=1 V、相位差為π兩路正弦波,其中同相輸出端的波形如圖6(a)所示,反相輸出端的波形如圖6(b)所示。

當(dāng)使能細(xì)胞捕獲生物芯片中第2行、第2列的微電極單元后,用示波器測量加載第2行、第2列的微單元所對應(yīng)下位機(jī)輸出通道的信號,圖7為測量波形圖。

4 結(jié)論
本文設(shè)計(jì)了一款專門適用于可尋址的高通量微電極陣列型細(xì)胞捕獲生物芯片的控制電路系統(tǒng),能夠?qū)崿F(xiàn)對32×32個微電極單元尋址、介電電泳電壓信號的選擇性加載、上位機(jī)程序UI控制等功能。該系統(tǒng)設(shè)計(jì)結(jié)構(gòu)簡單,采用上位機(jī)的人機(jī)交互界面操控。該系統(tǒng)的研發(fā)對進(jìn)一步促進(jìn)細(xì)胞介電電泳技術(shù)在腫瘤細(xì)胞的早期檢測方面的應(yīng)用具有重要意義。
參考文獻(xiàn)
[1] 呂曉慶,李雷,陳紅梅,等.微流控芯片技術(shù)在循環(huán)腫瘤細(xì)胞分離中的研究進(jìn)展[J].生物化學(xué)與生物物理進(jìn)展,2015,42(4):301-312.
[2] 王英慧,王麗茹,孫巍,等.晚期非小細(xì)胞肺癌患者外周血循環(huán)腫瘤細(xì)胞檢測5例并文獻(xiàn)復(fù)習(xí)[J].中國醫(yī)藥指南,2014(22):269-270.
[3] GASCOYNE P R,SHIM S.Isolation of circulating tumor cells by dielectrophoresis[J].Cancers,2014,6(1):545-579.
[4] SHIM S,STEMKEHALE K,NOSHARI J,et al.Dielectro-phoresis has broad applicability to marker-free isolation of tumor cells from blood by microfluidic systems[J].Biomi-crofluidics,2013,7(1):011808.
[5] HAROUAKA R A,NISIC M,ZHENG S Y.Circulating tumor cell enrichment based on physical properties[J].Journal of the Association for Laboratory Automation,2013,18(6):455-68.
[6] HUANG C,LIU C,LOO J,et al.Single cell viability observation in cell dielectrophoretic trapping on a microchip[J].Applied Physics Letters,2014,104(1):013703.
[7] FORSHAW J R,GODDARD P,YEOMANS J.Quantum chromodynamics and the pomeron[M].Cambridge University Press.,1997.
[8] 屈翠香,李剛.低成本高速差動放大器AD8132[J].電子設(shè)計(jì)工程,2001(11):25-27.
作者信息:
李生輝1,2,3,盧小冬2,黃成軍2,3
(1.中國科學(xué)院微電子研究所 健康電子研發(fā)中心,北京100029;
2.中國科學(xué)院微電子研究所 新一代通信射頻芯片技術(shù)北京市重點(diǎn)實(shí)驗(yàn)室,北京100029;
3.中國科學(xué)院大學(xué) 未來技術(shù)學(xué)院,北京101400)

